Acid boric – Wikipedia tiếng Việt

Acid boric là một acid yếu của bo, thường được dùng làm chất sát trùng, thuốc trừ sâu, dập lửa, dùng trong các nhà máy hạt nhân để khống chế tốc độ phân hạch của urani, và là chất ban đầu để điều chế ra các hợp chất hóa học khác. Nó tồn tại ở dạng các tinh thể không màu hoặc bột màu trắng và có thể hòa tan trong nước. Công thức hóa học của nó là H3BO3, đôi khi viết là B(OH)3. Khi ở dạng khoáng vật, nó được gọi là sassolit.
Acid dạng tự do được tìm thấy trong những vùng có núi lửa nhất định như ở Tuscany, quần đảo Lipari và Nevada, trộn lẫn với hơi nước trong những khe nứt trong đất ; nó cũng được tìm thấy ở dạng thành phần cấu trúc trong một số ít khoáng vật ( borax, boracit, boronatrocaicit và colemanit ). Acid boric và những muối của nó cũng được ghi nhận trong nước biển. Nó cũng sống sót trong thực vật và đặc biệt quan trọng là trong hầu hết trái cây. [ 1 ]
Acid boric được Wilhelm Homberg (1652–1715) điều chế lần đầu tiên từ borax, từ phản ứng của các acid vô cơ, và được đặt theo tên sal sedativum Hombergi (“muối giảm đau của Homberg”). Tuy nhiên, các borat, bao gồm cả acid boric, đã được sử dụng vào thời kỳ Ai Cập cổ đại để lau chùi, bản quản thực phẩm, và các ứng dụng khác.[cần dẫn nguồn]
Acid boric có thể được điều chế khi cho borax (natri tetraborat decahydrat) phản ứng với acid vô cơ, như acid chlorhydric:
Bạn đang đọc: Acid boric – Wikipedia tiếng Việt
- Na2B4O7·10H2O + 2HCl → 4B(OH)3 [hay H3BO3] + 2NaCl + 5H2O
Acid boric có thể tan trong nước sôi. Khi nung trên 170 ℃, nó tách nước tạo thành acid metaboric (HBO2):
- H3BO3 → HBO2 + H2O
Acid metaboric là chất rắn kết tinh theo hệ lập phương, có màu trắng và chỉ hòa tan ít trong nước. Acid metaboric nóng chảy ở 236 ℃, và khi nung trên 300 ℃ nó tiếp tục tách nước tạo thành acid tetraboric hay acid pyroboric (H2B4O7):
- 4HBO2 → H2B4O7 + H2O
Thuật ngữ acid boric đôi khi cũng được dùng để chỉ các hợp chất này. Nếu tiếp tục tách nước, nó sẽ tạo ra đibo trioxide:
- H2B4O7 → 2B2O3 + H2O
Acid boric không phân ly trong dung môi gốc nước như acid Brønsted, nhưng là một acid Lewis phản ứng với những phân tử nước để tạo thành ion tetrahydroxyborat, và được quan sát dưới quang phổ Raman [ 2 ] :
- B(OH)3 + H2O ⇌ B(OH)
−
4Xem thêm: Viên Uống Đẹp Da Sakura Beauty CHP
+ H+ (Ka = 5.8×10−10 mol/l; pKa = 9.24)
Các anion polyborat được tạo ra tạo thành dung dịch có pH 7–10 nếu nồng độ bo lớn hơn 0,025 mol/L. Ion phổ biến nhất là tetraborat được tìm thấy trong borax khoáng:
- 4B(OH)
−
4+ 2 H+ ⇌ B4O
2−
7+ 9H2O
Acid boric có vai trò quan trọng trong việc hấp thụ những sóng âm tần số thấp trong nước biển. [ 3 ]
Cấu trúc tinh thể[sửa|sửa mã nguồn]
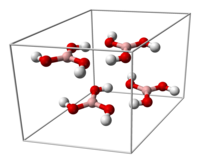
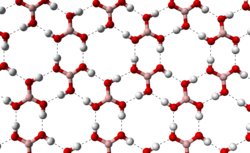
Acid boric tinh thể bao gồm các lớp phân tử B(OH)3 liên kết với nhau bởi liên kiết hydro. Khoảng cách giữa hai lớp cạnh nhau là 318 pm.
 |
|
| Ô cơ sở của acid boric | Liên kết hydro (đường đứt nét) cho phép các phân tử acid boric hình thành các lớp song song ở trạng thái rắn |
- Jolly, W. L. (1991). Modern Inorganic Chemistry (2nd Edn.). New York: McGraw-Hill. ISBN 0-07-112651-1.
- Louis Goodman, Alfred Gilman, Laurence Brunton, John Lazo and Keith Parker (2006). Goodman & Gilman’s The Pharmacological Basis of Therapeutics. New York: McGraw Hill.
Liên kết ngoài[sửa|sửa mã nguồn]
Source: https://trangdahieuqua.com
Category: Chăm sóc da



